

肺炎衣原体是一类进化来源不明、细胞内寄生并具有独特发育周期的革兰阴性微生物,其引起的肺炎症状一般较轻且无特异性。但近年来,关于肺炎衣原体感染导致重症表现的病例报告数逐渐增多,对肺炎衣原体感染的诊断也显得更为重要。
肺炎衣原体检测试剂盒被用于检测试验血清中的肺炎衣原体抗体/抗原,是目前实验室诊断肺炎衣原体感染的重要依据之一。酶联免疫吸附测定法(简称酶联免疫法)是肺炎衣原体检测试剂盒运用较广泛的检测方法。
酶联免疫法的检测原理
酶联免疫法的检测原理是在酶标板上包被特定的抗体/抗原后,利用直接或间接的方法与待测样品中的相关抗体/抗原反应,用形成的抗体抗原复合物与相应的酶标记的抗体/抗原进一步反应,经过酶催化底物发生显色反应,由显现的颜色强弱来判断样本中相应抗体/抗原的含量。
酶联免疫法检测原理的核心是让抗体与酶复合物结合,通过显色来进行检测,使抗原或抗体结合到某种固相载体表面,并保持其免疫活性,使抗原或抗体与某种酶连接成酶标抗原或抗体,这种酶标抗原或抗体既保留了其免疫活性,又保留了酶的活性。在测定时,把受检标本和酶标抗原或抗体按不同步骤与固相载体表面的抗原或抗体反应,再用洗涤的方法使固相载体上形成的抗原抗体复合物与其他物质分开。最后,结合在固相载体上的酶量与标本中受检物质的量成一定比例。
根据《体外诊断试剂注册管理办法》的规定,肺炎衣原体检测试剂盒(酶联免疫法)按第三类体外诊断试剂产品进行管理,对此类产品的监管主要依靠企业内部的风险管理控制和监管部门的定期检查来实现。由于肺炎衣原体感染引起的重症病例数逐年增加,对此类疾病的早期检查和发现变得尤为重要。
生产过程
肺炎衣原体检测试剂盒(酶联免疫法)的生产过程需遵循《医疗器械监督管理条例》《医疗器械生产监督管理办法》《医疗器械生产质量管理规范》《体外诊断试剂生产及质量控制技术指导原则——酶联免疫诊断试剂生产及质量控制技术指导原则》等的相关规定。
对此类产品的日常生产控制应参考相关监管规范要求,并结合产品风险建立合适的风险监控点。企业应结合产品的具体生产工艺,梳理生产环节,识别其中的风险,构建生产过程风险监测体系,并选取科学的分析方法形成风险监测及评估手段,提出相应的风险防控措施。
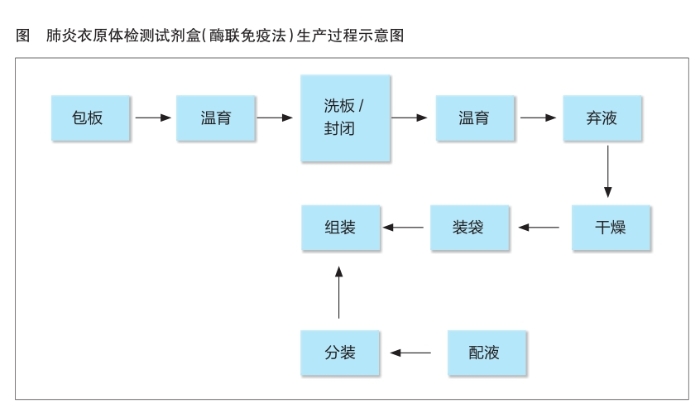
肺炎衣原体检测试剂盒(酶联免疫法)的生产过程包括包板、温育、洗板/封闭、弃液、干燥、装袋等工艺流程(见图)。对生产过程的质量控制决定着产品的质量水平,而对于关键工序的控制尤为重要。
风险点分析
在产品的设计开发环节,企业应关注原材料的开发、来源、使用等是否符合相关规定的要求。酶联免疫法中使用的原材料主要包括生物原料、生物辅料、化学原材料及其他物料。
生物原料与产品质量的关系最为密切,主要包括各种天然抗原、重组抗原、单克隆抗体、多克隆抗体及多肽类、激素类生物原料。此类原料可被用于包被酶标反应板、标记相关酶(如辣根过氧化物酶、碱性磷酸酶等)、中和反应用抗原或抗体、制备校准品和标准品等。由于大多数原料属于蛋白质类,在使用前应按工艺要求对其进行分子量、蛋白浓度、效价、纯度等的质量检验和性能验证,以确保原料达到规定的质量标准。
采购环节的风险点主要集中在以下几个方面:企业是否制定了供应商管理制度、是否从合格的供应商处采购物料、是否保存了供应商资质的相关文件、是否对主要原材料进行了批检验并确保整个过程可追溯,以及当供应商变更时,企业是否与新的供应商重新签订了质量协议,并对新供应商提供的原材料进行重新验证。
生产管理
肺炎衣原体检测试剂盒(酶联免疫法)生产过程中的关键环节有:
配制工作液 在该环节,企业应对各溶液的pH值、酶作用底物、在无相应酶情况下的自身显色情况、终止液的终止酶促反应能力等进行控制。
包被酶标反应板 企业应对包被过程进行相应的质量控制,包括:包被用原料(抗原或抗体等生物活性原料)的质量检验、包被液和封闭液的质量控制(如配方、外观、pH值等)、包被过程的监控(包被和封闭的体积、温度、时间等)、包被均一性检验、干燥过程的监控等。
分装和包装 企业应确保对样品稀释液、洗涤液、酶结合物或酶稀释液、底物或底物缓冲液等严格按照质量标准中规定的量过滤后再进行分装;并确认物料、中间品、成品在仓储场所和生产现场的储存条件符合相关要求。
生产管理环节中的风险点包括企业是否制定了物料抽样方法、检验标准、检验方法并进行检验记录;检验内容是否符合相关标准要求,并通过检验来确保产品的安全性和有效性;是否制定了留样制度和长期稳定性考察制度,并现场检查留样库,确保留样台账具有可追溯性。
此外,企业还应确认是否已建立对不良事件监测的相关规定,规定是否覆盖相关部门及人员的职责,以及监测程序、报告时限、报告途径、调查处置等内容;是否按规定开展了不良事件监测活动并持续保持记录;是否形成了纠正预防措施,以便及时确定问题出现的原因、采取措施纠正并防止其再次发生。
肺炎衣原体检测试剂盒(酶联免疫法)生产和质量控制的目的是保证试剂使用的安全、稳定,及检测有效性。这一目标的实现有赖于生产企业对原材料、生产过程等的质量控制,相关质控手段应环环相扣,不容许丝毫马虎。
来源于中国医药报
